CREDENCE y SONAR: lo último en ensayos clínicos ramdomizados para Nefropatía Diabética
CREDENCE
El domingo 14 de abril, durante el congreso mundial de nefrología (WCN) en Melbourne, Australia, se presentó y publicó el estudio CREDENCE de canagliflozina. Este estudio incluyó pacientes con DM2 con TFG entre 30 y 90 ml/min/1.73 m2 + macroalbuminuria (>300 a 5000 mg/g) que estaban recibiendo IECA.
El diseño incluyó dos ramas: canagliflozina 100 mg/día ("poquitita Canaglifozina") y placebo.
El end point primario fue el compuesto de “end-stage kidney disease” o ESKD (diálisis, trasplante o TFG sostenida <15 ml/min/1.73 m2), duplicación de la creatinina sérica (DSC), o muerte de causa renal o CV
El estudio fue detenido antes del tiempo estimado de finalización de acuerdo a la opinión de un comité evaluador por los resultados favorables en la rama canagliflozina. Se detuvo cuando se habían reclutado un total de 4401 pacientes, con una media de seguimiento de 2,62 años.
Los resultados fueron:
Endpoint |
Reducción del riesgo relativo vs Placebo |
P Valor |
ESKD, DSC, muerte renal o CV |
30% |
P=0.00001 |
ESKD, DSC, muerte renal |
34 % |
P<0.001 |
ESKD |
32% |
P=0.002 |
3P-MACE |
20% |
P=0.01 |
Muerte CV o HHF |
31% |
P<0.001 |
HHF |
39% |
P<0.001 |
Muerte CV |
22% |
P=0.05 No significativa |
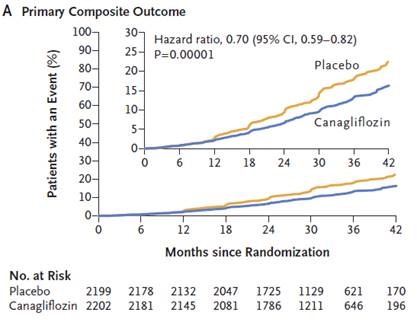
Se han calculado un NNT a 2,5 años para el end point primario de 22 pacientes por un caso evitado.
No hubo ningún evento adverso inesperado ni desbalances en amputaciones y fracturas.
Como conclusiones:
· El estudio CREDENCE reafirma el beneficio a nivel renal que se ha observado en otros grandes estudios clínicos de la clase iSGLT2.
· También vuelve a mostrar beneficios en relación a hospitalizaciones por falla cardíaca
· A diferencia de los resultados del EMPA-REG OUTCOME, no se ha visto una disminución en el riesgo de muerte CV con canagliflozina
· No ha mostrado más riesgo de fracturas y amputaciones, por lo tanto continúa el interrogante de por qué se observó este desbalance solamente con canagliflozina en el estudio CANVAS y no en otros de la molécula ni de la clase, sobretodo porque esta población renal podría tener más riesgo de fracturas por alteraciones en el metabolismo fosfo-cálcico.
SONAR
SONAR fue un estudio aleatorizado, doble ciego, paralelo, controlado con placebo, multicéntrico, diseñado para evaluar los efectos de atrasentan (0,75 mg administrados por vía oral una vez al día) en los resultados renales en pacientes con nefropatía diabética tipo 2 (enfermedad renal diabética), mientras continuaban siendo tratados con el estándar de atención actual: la dosis diaria máxima etiquetada tolerada de un inhibidor de SRA, es decir un inhibidor de la ECA o un BRA, y un diurético.
Los criterios de inclusión para los pacientes incluían la TFG estimada de 25 a 75 ml / min / 1.73 m2, UACR ≥300 y <5,000 mg y presión arterial sistólica dentro de 110 y 180 mmHg (inclusive).
El objetivo principal fue evaluar el efecto de atrasentan a tiempo para duplicar la creatinina sérica o el inicio de la ERCT, según lo definido por la necesidad de diálisis crónica, trasplante o muerte debido a insuficiencia renal. Los criterios de valoración secundarios evaluarán los efectos de atrasentan en la excreción de albúmina en orina, TFGe y eventos cardiovasculares que incluyeron muerte cardiovascular, ataque cardíaco y accidente cerebrovascular. También se realizaron evaluaciones de calidad de vida.
Después de la selección inicial, los pacientes se inscribieron en un período de ejecución para optimizar el inhibidor de RAS y las dosis de diuréticos. Los pacientes elegibles entraron en un período de enriquecimiento, en el que recibieron atrasentan 0,75 mg / día durante seis semanas para determinar su respuesta UACR y evaluar la tolerabilidad de atrasentan.
Entre el 17 de mayo de 2013 y el 13 de julio de 2017, se examinaron 11 087 pacientes; 5117 entraron en el período de enriquecimiento, y 4711 completaron el periodo de enriquecimiento. De estos, 2648 pacientes respondieron y fueron asignados al azar al grupo atrasentan (n = 1325) o el grupo placebo (n = 1323). La mediana de seguimiento fue de 2 · 2 años (IQR 1 · 4–2 · 9). 79 (6 · 0%) de 1325 pacientes en el grupo de atrasentan y 105 (7 · 9%) de 1323 en el grupo de placebo que alcanzaron el end point del compuesto primario renal (relación de riesgo [HR] 0 · 65 [IC 95% 0 · 49–0 · 88]; p = 0 · 0047). La retención de líquidos y anemia son eventos adversos que se han atribuido previamente a los antagonistas de los receptores de endotelina; eventos que fueron más frecuentes en el grupo atrasentan que en el grupo placebo. El ingreso hospitalario por insuficiencia cardíaca ocurrió en 47 (3 · 5%) de 1325 pacientes en el atrasentan grupo y 34 (2 · 6%) de 1323 pacientes en el grupo placebo (HR 1 · 33 [IC 95% 0 · 85–2 · 07]; p = 0 · 208). 58 (4 · 4%) pacientes en el grupo de atrasentan y 52 (3 · 9%) en el grupo de placebo murieron (HR 1 · 09 [IC 95% 0 · 75–1 · 59]; p = 0 · 65).
Atrasentan redujo el riesgo de eventos renales en pacientes con diabetes y enfermedad renal crónica que fueron seleccionados para optimizar la eficacia y seguridad. Estos datos apoyan un papel potencial para los antagonistas del receptor selectivo de endotelina en la protección de la función renal en pacientes con diabetes tipo 2, con alto riesgo de desarrollar ERCT.
Dr Eduardo Lorca
Referencias
1.- Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. Credence Strudy. NEJM 2019. DOI: 10.1056/NEJMoa1811744
2.- Atrasentan and renal events in patients with type 2 diabetes and chronic kidney disease (SONAR): a double-blind, randomised, placebo-controlled trial. Lancet 2019 http://dx.doi.org/10.1016/ S0140-6736(19)30772-X



